4 medicamentos que los médicos nunca volverán a recetar

Cuando confíe su salud a un médico, puede pensar que los dos son las únicas partes que hacen llamadas cruciales sobre su bienestar. Pero en el momento en que su médico saca una almohadilla de receta, ese círculo de confianza se expande para incluir compañías farmacéuticas y agencias reguladoras. Desafortunadamente, como todos sabemos por retiros de alto perfil en los que se retiran los medicamentos del mercado, la industria farmacéutica a veces comete errores. Si bien todos los medicamentos vienen con riesgos y beneficios, ciertos productos han demostrado ser simplemente demasiado peligrosos para tomar, causando daños evitables e irreversibles, o incluso la muerte.
Mientras tanto, muchas drogas con efectos secundarios graves permanecen en el mercado, o regresan después de un breve retiro. Se necesitan mucho para que las drogas sean sacadas de los estantes de forma permanente, pero sucede. Siga leyendo para averiguar sobre cuatro medicamentos que los médicos probablemente nunca volverán a recetar y escuchar las sorprendentes historias de por qué ya no se les prescribe.
Lea esto a continuación: las principales farmacias están bloqueando este medicamento diario común.
1 Vioxx para artritis

Vioxx es un inhibidor de COX-2 que una vez se usó comúnmente para tratar la artritis. Pero en 2004, el fabricante del medicamento, Merck & Co., Si se hubiera retirado del mercado cuando la noticia se había relacionado con 88,000 ataques cardíacos entre 1999 y 2003-38,000 de los cuales eran fatales. Para cuando se sacó del mercado, se estimó que más de 20 millones de pacientes habían tomado el medicamento. En 2007, Merck alcanzó un 4.Según NPR, un acuerdo de 85 mil millones de dólares para resolver miles de demandas, el acuerdo de drogas más grande de la historia, según NPR.
"Ciertamente existe la necesidad de inhibidores de COX-2, pero en última instancia, las compañías farmacéuticas los comercializaban de manera incorrecta para usar dosis más altas", dice William Soliman, PhD, BCMA, fundador y CEO del Consejo de Acreditación de Asuntos Médicos (ACMA) y un ejecutivo farmacéutico que anteriormente trabajó con Merck. "En mi opinión, esto condujo a parte del riesgo cardiovascular", dice Soliman Mejor vida.
2 Bextra para alivio del dolor

Valdecoxib, marcado como Bextra, es un medicamento antiinflamatorio no esteroideo (AINE) que alguna vez se prescribió como analgésico. Sin embargo, en 2005, los investigadores se enteraron de que la droga causó complicaciones cardiovasculares graves y, a veces, fatales, como el ataque cardíaco y el accidente cerebrovascular. Raramente, también se descubrió que Bextra causa dos reacciones de la piel potencialmente fatales conocidas como Síndrome de Stevens-Johnson y necrólisis epidérmica tóxica.
Habiendo determinado que Bextra no tenía una ventaja particular sobre analgésicos similares que no causaron complicaciones tan graves, la FDA se movió para suspender su uso.
3 Belviq para perder peso

Lorcaserin, marcada como Belviq o Belviq XR, se recetó previamente como un medicamento para la pérdida de peso después de ser aprobado en 2012. Sin embargo, en 2020 la FDA instruyó a los médicos a dejar de recetar lorcaserina después de que un estudio reveló un vínculo entre el medicamento y el cáncer. ae0fcc31ae342fd3a1346ebb1f342fcb
"Estamos tomando estas medidas porque creemos que los riesgos de Lorcaserin superan sus beneficios basados en nuestra revisión completa de los resultados de un ensayo clínico aleatorizado que evalúa la seguridad", escribió la FDA en su anuncio de retiro. "Los profesionales de la salud deben dejar de recetar y dispensar la lorcaserina a los pacientes. Contacte a los pacientes que actualmente toman lorcaserin, infórmeles sobre la mayor aparición de cáncer observado en el ensayo clínico y pídales que dejen de tomar el medicamento. Discutir medicamentos o estrategias alternativas de pérdida de peso con sus pacientes ", aconsejó el organismo regulador.
Para obtener más noticias de salud enviadas directamente a su bandeja de entrada, regístrese en nuestro boletín diario.
4 Raptiva para psoriasis
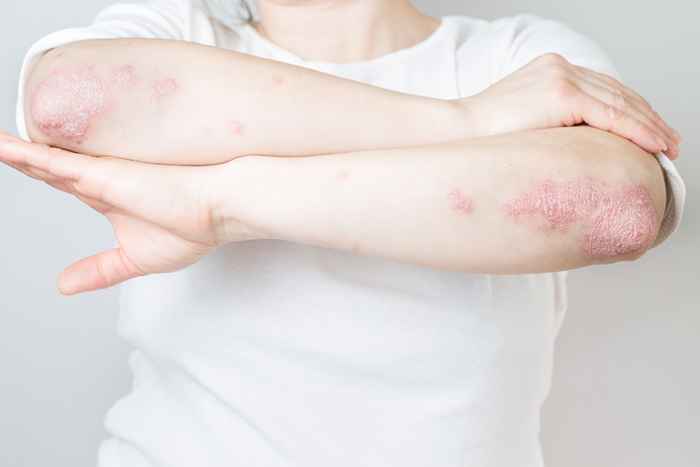
Efalizumab, marcado como Raptiva, era un medicamento inyectable que una vez se usaba para tratar a adultos con psoriasis de placa moderada a severa. Sin embargo, en 2009, su productor lanzó "una retirada voluntaria y gradual del producto del U.S. mercado."
Esto se debe a que los científicos aprendieron que el medicamento se había relacionado con la leucoencefalopatía multifocal progresiva (PML), una enfermedad neurológica rara pero grave causada por un virus que afecta el sistema nervioso central. En su aviso de retirada de drogas, la FDA señaló que no se conoce "un tratamiento efectivo conocido para PML", y aunque es poco probable que cualquier individuo que tome Raptiva desarrolle la enfermedad, en última instancia puede ser fatal en aquellos que lo contratan.
Best Life ofrece la información más actualizada de los principales expertos, nuevas investigaciones y agencias de salud, pero nuestro contenido no debe ser un sustituto de la orientación profesional. Cuando se trata del medicamento que está tomando o cualquier otra pregunta de salud que tenga, consulte siempre a su proveedor de atención médica directamente.


