Si usa este medicamento común, hable con su médico ahora, la FDA advierte

Lo que sea que esté en su botiquín, desea sentirse seguro de que todo lo que está tomando es seguro consumir. Ya sea que use una receta diaria o alcance los antiácidos después de una gran comida, confiamos en medicamentos para ayudarnos en lugar de lastimarnos. Ahora, se acaba de retirarse un medicamento común, y querrá comunicarse con su médico de inmediato si tiene una de las botellas afectadas. Siga leyendo para obtener más información sobre el producto Pfizer que U.S. La advertencia de la Administración de Alimentos y Medicamentos (FDA) podría hacer más daño que bien.
RELACIONADO: Estas acidez de acidez y dolor común se retiraron, la FDA advierte.
El nombre de Pfizer ahora se reconoce fácilmente.

En los últimos años, Pfizer se ha convertido en un nombre familiar. La compañía es reconocida por haber fabricado la primera vacuna Covid-19 del país, junto con Biontech, después de haber sido aprobada originalmente por la FDA en diciembre. 2020. Según la revisión anual 2021 de Pfizer, se produjeron casi 3 mil millones de dosis de la vacuna en 2021, y se proyecta que 4 mil millones se fabricarán en 2022.
Sin embargo, antes de aparecer en los titulares durante la pandemia, Pfizer era ampliamente conocido por los tratamientos producidos para otras afecciones médicas, desde depresión (en forma de pristiq) hasta fibromialgia (a través de Lyrica). Ahora, la compañía farmacéutica recuerda muchos medicamentos populares, que se utiliza para tratar una condición aún más común.
Se han retirado cinco lotes de un medicamento Pfizer.
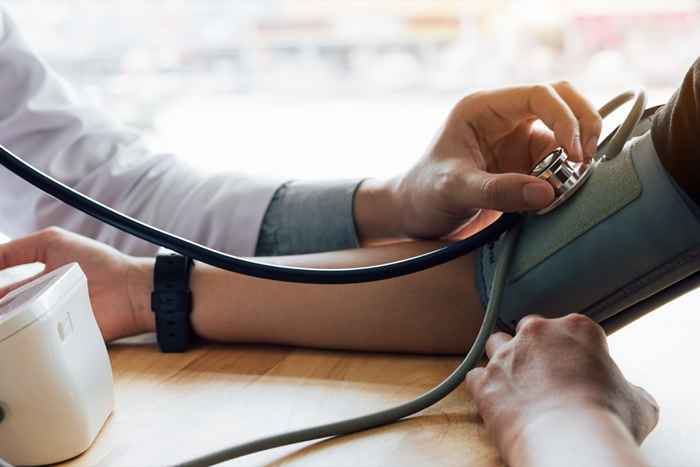
Los Centros para el Control y la Prevención de Enfermedades (CDC) estima que casi la mitad de los estadounidenses tienen hipertensión, pero solo alrededor de una cuarta parte de estas personas tienen su condición bajo control. Accupril es un medicamento a menudo prescrito para el tratamiento de la presión arterial alta, pero algunos de estos productos ahora podrían representar mayores amenazas para su salud.
El 22 de abril, la FDA anunció que Pfizer retiraba voluntariamente cinco lotes de tabletas Accupril después de que las pruebas encontraron niveles elevados de nitrosamina, o nnitroso-quinapril, un agente potencial que causa el cáncer. Según el anuncio de la FDA, las nitrosaminas a menudo se encuentran en agua y alimentos, así como carnes curadas y a la parrilla, productos lácteos y verduras. El riesgo de cáncer aumenta cuando las personas están expuestas a niveles más altos durante períodos prolongados de tiempo. ae0fcc31ae342fd3a1346ebb1f342fcb
RELACIONADO: Para obtener información más actualizada, regístrese en nuestro boletín diario.
Debe verificar su medicamento para ver si es parte del retiro.

Además del tratamiento de la hipertensión, también puede tomar Accupril como terapia complementaria para el manejo de la insuficiencia cardíaca, cuando se combina con diuréticos y/o digital (los enfoques de terapia convencionales), según la advertencia de la FDA. Las personas que toman Accupril (también conocidas por su nombre genérico, el clorhidrato de quinapril) para cualquiera de estas condiciones debe verificar si sus productos son parte del retiro del mercado.
En su botella, busque el Código Nacional de Drogas (NDC), que figura en la parte superior de la etiqueta, así como el número de lote y la fecha de vencimiento, en el lado izquierdo de la etiqueta. Todos los productos afectados tenían 90 tabletas cada una.
El producto de 10 mg retirado tiene un NDC de 0071-053-23, mucho número de DR9639 y una fecha de vencimiento del 31 de marzo de 2023. Los productos retirados de 20 mg tienen un NDC de 0071-0532-23, números de lote de DX8682 y DG1188, y fechas de vencimiento del 31 de marzo de 2023 y el 31 de mayo de 2022, respectivamente. Los productos retirados de 40 mg tienen un NDC de 0071-0535-23. Los productos del número de lote DX6031 tienen una fecha de vencimiento del 31 de marzo de 2023, mientras que los productos del número de lote CK6260 tienen una fecha de vencimiento del 31 de mayo de 2022.
Los lotes de productos retirados se distribuyeron a mayoristas y distribuidores en toda la U.S. y Puerto Rico entre diciembre. 2019 y abril de 2022, dijo la FDA.
Si tiene uno de los productos afectados, comuníquese con su proveedor de atención médica.

En el anuncio de la FDA, Pfizer declaró que el beneficio/perfil de riesgo de Accupril "sigue siendo positivo en función de los datos disponibles actualmente" y no ha habido informes de eventos adversos relacionados con el retiro hasta la fecha. Y aunque la ingestión a largo plazo de las nitrosaminas puede estar asociada con un aumento del riesgo de cáncer, "no hay riesgo inmediato para los pacientes que toman este medicamento."
Sin embargo, si tiene este medicamento retirado, se le recomienda contactar a sus médicos o proveedores de atención médica sobre opciones de tratamiento alternativas. Para obtener información sobre cómo devolver el producto y recibir un reembolso, los pacientes también deben comunicarse con Sedgwick al 888-345-0481 entre 8 A.metro. y 5 P.metro. Hora del este, de lunes a viernes. La FDA también le pide que informe cualquier reacción adversa o problema de calidad al programa de Informe de eventos adversos de MedWatch en línea, o por correo regular o fax.
Los mayoristas y las distribuciones tienen instrucciones de detener la distribución inmediata y poner en cuarentena los productos afectados que puedan tener. Si los productos se distribuyeron aún más a ubicaciones adicionales, las empresas deben notificar a los destinatarios y "realizar una subproceso."
Relacionado: si usa este medicamento común, llame a su médico ahora, la FDA advierte.


